Reaksi
Eliminasi
Dapat dikatakan bahwa Eliminasi adalah salah satu jenis yang mana ada dua substituen dipisahkan dari suatu molekul baik dalam mekanisme satu tahap atau dua tahap. Mekanisme yang terjadi dengan satu tahap dikenal sebagai reaksi E2, dan mekanisme yang terjadi lebih dari satu tahap (dua tahap) dikenal dengan reaksi E1. Angka yang ada di nama reaksi tidak berberkaitan dengan jumlah tahapan dalam mekanisme tersebut,tetapi berhubungan dengan kinetika raksi bimolekular dan unimolekular berturut.
Reaksi E2
Jika alkil halida mempunyai atom hidrogennya pada atom karbon yang
bersebelahan dengan karbon pembawa halogen bereaksi dengan karbon pembawa
halogen akan bereaksi dengan nukleofil maka terdapat dua kemungkinan reaksi
yang bersaing yakni substitusi dan eliminasi.
Sering kali reaksi substitusi dan eliminasi terjadi secara bersamaan pada
pasangan pereaksi nukleofil dan substrat yang sama. Reaksi mana yang dominan cenderung
bergantung pada kekuatan nukleofil, struktur substrat dan kondisi reaksi. Seperti
halnya dengan reaksi substitusi reaksi eliminasi juga memiliki dua mekanisme
yaitu mekanisme E2 dan E1.
Reaksi eliminasi alkil halida yang paling berguna yakni reaksi E2
(eliminasi bimolekuler). Reaksi E2 alkil halida cenderung dominan bila
digunakan pada basa kuat, seperti –OH dan –OR, dan pada temperatur yang
tinggi. ciri khas reaksi E2 dilakukan dengan memanaskan alkil halida
dengan K+-OH atau Na+ -OCH2CH3
dalam etanol.
Reaksi E2 berjalan tidak lewat suatu karbokation sebagai zat-antara,
melainkan berupa reaksi serempak (concered reaction) terjadi
pada satu tahap, sama seperti reaksi SN2.
- Basa akan membentuk ikatan dengan hidrogen
- Elektron C-H membentuk ikatan PI
- Brom dengan satu pasang elektronnya pergi meninggalkan ikatan sigma C-Br
Persamaan diatas menunjukkan mekanisme, dengan anak-panah bengkok
menyatakan “pendorongan elektron” (electron-pushing). Struktur
keadaan-transisi dalam reaksi satu tahap ini adalah:
Pada reaksi E2, sama seperti reaksi E1, alkil halida tersier akan bereaksi
paling cepat dari pada alkil halida primer . (jika kita mengolah dengan suatu
basa, alkil halida primer biasanya begitu mudah bereaksi substitusi, sehingga
hanya sedikit alkena terbentuk).
Stereokimia
Suatu Reaksi E2
Disaat berada pada keadaan transisi suatu eliminasi E2, basa yang menyerang dan gugus
yang pergi umumya sejauh mungkin, atau anti. Karena inilah maka eliminasi E2
seringkali merujuk sebagai anti-eliminasi.
Ciri yang menarik mengenai anti-eliminasi adalah bahwa peletakan anti dari
H dan Br yang akan dibuang menentukan streokimia alkena sebagai produk. Untuk
memahami terjadinya hal ini, perhatikan reaksi E2 dari beberapa halida
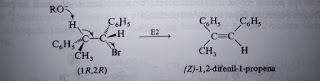
streoisomerik. Senyawa 1-bromo-1,2-difenilpropana mempunyai dua atom karbon
kiral (karbon 1 dan 2) dan empat streoisomer.
Karena terdapat hanya satu hidrogen β dalam halida awal, maka streoisomer
yang manapun akan menghasilkan C6H5(CH3)C=CHC6H5.
Namun dalam produk ini dapat terjadi keisomeran geometrik.
Bila atau (1R,2R)-1-bromo-1,2-difenilpropana ataupun (1S,2S)-enantiomernya
menjalani reaksi E2, akan terbentuk (Z)-alkena secara ekslusif; tak akan terbentuk
(E)-alkena.
Aturan Zaitev Untuk Reaksi Eliminasi
Pada eliminasi HX dari alkil halida
produk alkena yang lebih tersubstitusi adalah produk yang dominan.
Mekanisme E2
Reaksi E2 atau proses
satu tahap. Nukleofil bertindak sebagai basa dan mengambil proton (hidrogen)
dari atom karbon yang bersebelahan dengan karbon pembawa gugus pergi. Pada waktu
yang bersamaan, gugus pergi terlepas dan ikatan rangkap dua terbentuk.
Konfigurasi yang terbaik
untuk reaksi E2 adalah konfigurasi dimana hidrogen akan tereleminasi dalam
proses anti dengan gugus pergi. Alasannya ialah bahwa pada posii tersebut
orbital ikatan CH dan CX tersusun sempurna yang memudahkan pertumpangan
tindihan orbital dalam pembentukan ikatan baru.
Karakteristik
mekanisme reaksi ini diantaranya:
- E2 merupakan eliminasi satu tahap, dengan satu keadaan transisi.
- Biasanya terjadi pada alkil halida primer tersubstitusi, namun mungkin terjadi pada alkil halida sekunder dan senyawa lainnya.
- laju reaksi mengikuti orde kedua, karena reaksi dipengaruhi oleh alkil halida dan basa .
- Karena mekanisme E2 menghasilkan pembentukan ikatan pi, dua gugus pergi (terkadang sebuah atom hidrogen dan suatu halogen harus antiperiplanar.keadaan transisi antiperiplanar memiliki konformasi goyang (staggered) dengan energi yang lebih rendah dibanding keadaan transisi sinperiplanar di mana konformasi eklips dengan jumlah energi yang lebih besar atau tinggi. Mekanisme reaksi yang melibatkan konformasi goyang lebih disukai pada reaksi E2 (tidak seperti reaksi E1)
- E2 biasanya menggunakan basa yang kuat. Basa harus cukup kuat untuk melepas hidrogen yang kurang asam.
- Agar ikatan pi dapat terbentuk, hibridiasi karbon harus lebih rendah dari sp3 menjadi sp2.
- Ikatan C-H dilemahkan dalam tahap penentu laju dan karenanya efek isotop deuterium primer lebih besar dari 1 (biasanya 2-6) teramati.
- E2 berkompetisi dengan mekanisme reaksi SN2 jika basa dapat bertindak pula sebagai nukleofil (pada banyak basa yang umum).
Contoh tipe reaksi ini dalam skema 1 yaitu reaksi isobutilbromida dengan kalium etoksida dalam etanol Produk reaksi tersebut adalah isobutilena, etanol dan kalim bromida.
Permasalahan:
- Pada reaksi eliminasi yang melibatkan pelepasan HX dan hasilnya adalah suatu alkena, apakah hasil dari suatu reaksi eliminasi itu harus suatu alkena atau bisakah hasilnya alkana maupun alkuna?
- Seperti yang diketahui hasil dari reaksi elimInasi itu adalah alkena,dimana menurut aturan zeitsev, alkena yang lebih stabil akan dihasilkan lebih banyak dibandingkan dengan alkena yang kurang stabil, mengapa ini dapat terjadi?
- Pada reaksi substitusi dan eleminasi terjadi secara bersamaan pada pasangan pereaksi nukleofil dan substrat yang sama. Reaksi mana yang dominan, bergantung pada kekuatan nukleofil, struktur substrat dan kondisi reaksi. Pada kondisi yang bagaimana reaksi eliminasi lebih dominan?
Daftar Pustaka
Fessenden, Ralp
J and Joan S. Fessenden. 1986. Kimia Organiik jilid 1, 3ed. Terjemahan
A. Jakarta: Erlangga.
https://id.wikipedia.org/wiki/Reaksi_eliminasi









Assalamu'alaikum
BalasHapusSaya Anis nabila (RSA1C117014) ingin membantu mencoba menjawab pertanyaan saudari siti yg no 2 . Menurut saya, alkena kurang stabil karena memiliki tegangan sterik diantara kedua substituen yg posisi nya sama dan dapat kitanketahui dari perhirungan panas pembakaran yang diperlukan dalam asam kuat. Alkena akan lebih stabil dengan peningkatan substituennya karena jumlah substituen pada alkena akan menurunkan delta H0 hidrogenasi, sedangkan alkena itu sendiri lebih stabil karena tidak ada halangan steriknya sehingga mudah stabil
Semoga bermanfaat, terimakasih :)
Terimakasih artikel anda sangat bermanfaat
BalasHapusPerkenalkan nama saya Tiurma Refina silaban (RSA1C117011) saya akan mencoba menjawab pertanyaan nomor 3, yaitu pada kondisi bagaimana reaksli eliminasi sangat dominan? Menurut literatur yang saya baca Reaksi E2 alkil halida cenderung dominan bila digunakan basa kuat, seperti –OH dan –OR, dan temperatur tinggi. Secara khas reaksi E2 dilaksanakan dengan memanaskan alkil halida dengan K+-OH atau Na+ -OCH2CH3 dalam etanol.
Alkil halida cenderung dominan pada saat menggonakan basa kuat, karena basa yang digunakan biasanya harus lebih kuat untuk melepas hidrogen yang sedikit asam.
Semoga dapat membantu
Perkenalkan saya Endah Sulityawati. Ryt (RSA1C117013) Akan mencoba menjawab pertanyaan saudari siti nomor 1 yaitu menurut saya Iya reaksi eliminasi menghasilkan alkena, sebab satu hidrogen dilepaskan membentuk ikatan rangka dua. Artinya akan terbentuk molekul tak jenuh. Hal ini memungkinkan bahwa sebuah molekul melangsungkan reaksi eliminasi reduktif, dimana valensi atom pada molekul menurun dua. Jenis reaksi eliminasi yang penting melibatkan alkil halida, dengan gugus pergi yang baik, bereaksi dengan basa lewis membentuk alkena.
BalasHapus